

当CART小姐遇上CRISPR先生
发布日期:2016-12-08 浏览次数:2484

图片为笔者最喜欢的电影之一(当哈利遇到莎莉)
当今生物技术领域最为火热的两个技术当属CART和CRISPR技术,这两项技术在2013年Science杂志评选的科学十大突破中分别位列第一和第二。
某天,当刚消灭一大波肿瘤细胞处于亢奋状态的CART小姐遇上刚编辑完一大段基因序列想要放空休息的CRISPR先生时,傲娇的CART小姐有话要说:
 CART小姐:喂,Science杂志的排名你认同吗?
CART小姐:喂,Science杂志的排名你认同吗?
CRISPR先生:
哦,当然认同,你那么厉害,排在你身后是我的荣幸。
听说你已经在很多血液肿瘤的治疗上取得了非常显著的效果,尤其是针对CD19抗原的B系血液肿瘤,目前大量的临床实验已经在全世界展开,相信很快就能推广到临床实践造福患者。
 CART小姐:
CART小姐:
哼,算你识相,你也很不错嘛!只有你能精确定位到特定的DNA序列上面,切切敲敲改变它们。你那么好用,那么高效,科学家们可是已经让你成功改造过很多不同的细胞和物种呢。
CRISPR先生:抿嘴轻笑)我倒是有个不成熟的小建议,我俩联手怎么样?
 CART小姐:(露出了好奇的目光)怎么说?
CART小姐:(露出了好奇的目光)怎么说?
CRISPR先生:
你能够精确识别肿瘤细胞,我可以精确修改基因序列。可是你太金贵了,也太少了。
目前,绝大多数CART制备流程都是自体化治疗(autologous adoptive cell transfer),即从患者自身血液中分离T细胞,然后用表达CAR基因的病毒去侵染这些T细胞形成CART细胞,然后再将这些表达CAR蛋白的T细胞回输给病人进行治疗(如下图所示)。
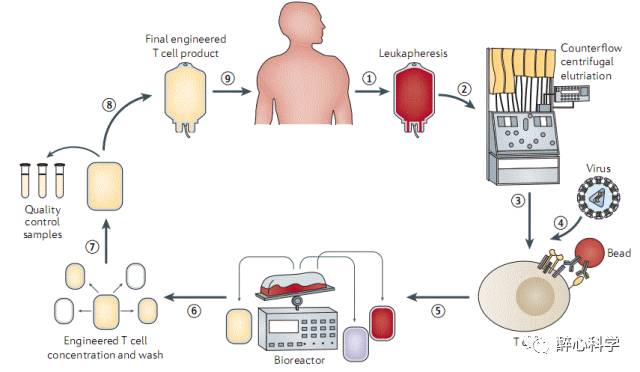
Fesnak AD etal. (2016) Nature Reviews Cancer
这种自体回输的方法虽然非常有效, 但费用昂贵并且耗时耗力。对于部分患者如新生儿及老年患者,很难获得足量且状态良好的淋巴细胞用于CART细胞治疗。目前CART治疗的一个重要研究方向是怎样使用一个健康献血者的T细胞制备大量的CART细胞,满足几百名患者的临床使用。
这一技术的建立将极大降低CART疗法的成本,可以更好的保证统一制备的细胞的质量,而且患者在需要时可以马上得到CART细胞进行治疗。因此,使用异体过继细胞,即制备通用的CART细胞用于癌症免疫治疗,将大大改善目前的应用瓶颈。
 CART小姐:(傲娇脸)我才不是随随便便就能得到的呢!可是,我也想帮助更多人呐,好苦恼!
CART小姐:(傲娇脸)我才不是随随便便就能得到的呢!可是,我也想帮助更多人呐,好苦恼!
CRISPR先生:别哭,让我来帮你,我想给你一个全新的生活环境。
要想使用异体的CART细胞治疗多个患者,必须保证其安全性,确保过继细胞不能攻击患者自身细胞,同时需要降低其自身的免疫原性避免宿主细胞的攻击。为了达成这两个目的,CRISPR技术在这里就有了用武之地。
利用CRISPR可以将αβ T-cell receptor (TCR)从异体的CART细胞中敲除,避免移植物抗宿主病(graft-versus-host-disease,GVHD)的发生,同时将人类白细胞抗原(HLA)敲除降低自身的免疫原性。
另外,PD-1是同肿瘤免疫逃逸相关的T细胞表面抑制因子,考虑到阻断PD-1信号通路在许多肿瘤类型中都取得了较好的疗效,这一工作同时在CART细胞中敲除了PD-1基因,来阻断PD-1信号通路。制备异体CART细胞需要进行多基因同时编辑,CRISPR-Cas9这一RNA介导的DNA核酸酶系统是非常适合的技术平台。
 CART小姐:真的吗?好心动呀!可是能行吗?
CART小姐:真的吗?好心动呀!可是能行吗?
CRISPR先生:
相信我!有一个美国科学家和一个中国科学家团队已经帮我们想出了方法。
说着CRISPR先生拿出了两篇近期发表的论文,一篇是发表在Clinical Cancer Research上面的论文,题为“ Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition.”,由宾州大学的团队完成,责任作者是Yangbing Zhao和CART领域的领军人物Carl June。
另外一篇是发表在Nature旗下的 Cell Research杂志的题为 “CRISPR-Cas9 mediated multiplex gene editing in CAR-T cells”的论文,该文由中国科学院动物研究所王皓毅研究组与宣武医院以及北京脐带血库合作完成,刘晓娟,张永平和程晨为论文共同第一作者。
这两个研究组都利用CRISPR-Cas9系统对CART细胞进行双基因(TRAC和B2M)或者三基因(TRAC,B2M及PD-1)敲除。结果表明,这些经过基因编辑的CART细胞同普通CART细胞相比,在体外及体内具有相当或更强的肿瘤细胞杀伤功能,可望成为临床应用的效应细胞。他们的研究建立了在CART细胞中利用CRISPR技术进行多基因敲除的方法,为通用型CART的制备提供了技术平台。

Liu et al., (2016) Cell Research
该图表明经过双基因敲除的CART细胞可以有效得在小鼠体内清除肿瘤
 CART小姐:(激动地伸出了手)那就让我们牵手试试
CART小姐:(激动地伸出了手)那就让我们牵手试试
CRISPR先生(宠溺地笑着说)好!
lalalala~~~Happy Ending

CART技术和CRISPR技术的结合远远不止这一方面的应用,基因编辑可以从根本上改变CART细胞的命运,还有无尽的可能性等着我们去探索。
 CART小姐何许人也?
CART小姐何许人也?
CART的全名是Chimeric Antigen Receptor T cell,中文翻译为“嵌合抗原受体T细胞”。Chimeric Antigen Receptor(CAR,嵌合抗原受体)是由人工设计合成的跨膜蛋白, 包括细胞外、跨细胞膜、以及细胞内三个部分。CAR的细胞外部分主要是识别特定抗原的单克隆抗体的可变区(scFV),负责识别特异性抗原。跨膜区确保CAR可以在细胞膜上定位,而细胞内区域则负责激活T细胞,产生T细胞介导的免疫反应。

图片来自于Wiki
科学家利用不同的方法(病毒或转座子)将CAR基因整合在T细胞基因组中,这些表达CAR蛋白的T细胞就被称之为CART细胞。当CAR的细胞外scFV部分识别肿瘤细胞的表面抗原的时候,CAR的细胞内区域就会激活T细胞,从而产生CART细胞介导的对于肿瘤细胞的特异性杀伤。CART疗法已经在治疗很多血液肿瘤方面取得了非常显著的效果,尤其是针对CD19抗原的B系血液肿瘤,目前大量的临床实验已经在全世界展开(数量最多的是在美国和中国),以期能够尽快推广到临床实践造福广大患者。
CRISPR先生又是谁?
CRISPR是规律成簇间隔短回文重复序列(Clustered regularly Interspaced Short Palidromic Repeats, CRISPR/Cas)名字的缩写,是在细菌和古菌中存在的一大类抵御病毒等外源核酸分子的防御机制。 这一系统编码的Cas9蛋白可以借助两个小RNA(tracrRNA和crRNA)精确的定位到特定的DNA序列上面(见下图),实现基因的编辑(即精确改变目标DNA序列)。
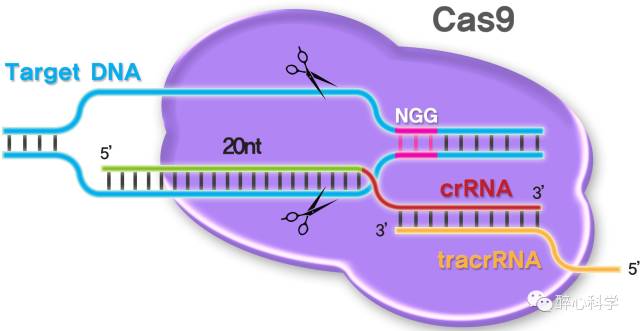
图片来自于网络
这一系统被科学家们优化并应用到不同的细胞和物种里面,因为CRISPR能够在绝大多数的物种中非常高效的工作,而且设计和使用简便, 很快成为了最炙手可热的生物学技术。这一技术不仅在科学研究上具有巨大的作用,在治疗疾病方面也有非常广阔的前景。
作者言:以上情景纯属虚构,如有雷同,您就暂且一乐。
来源:醉心科学
